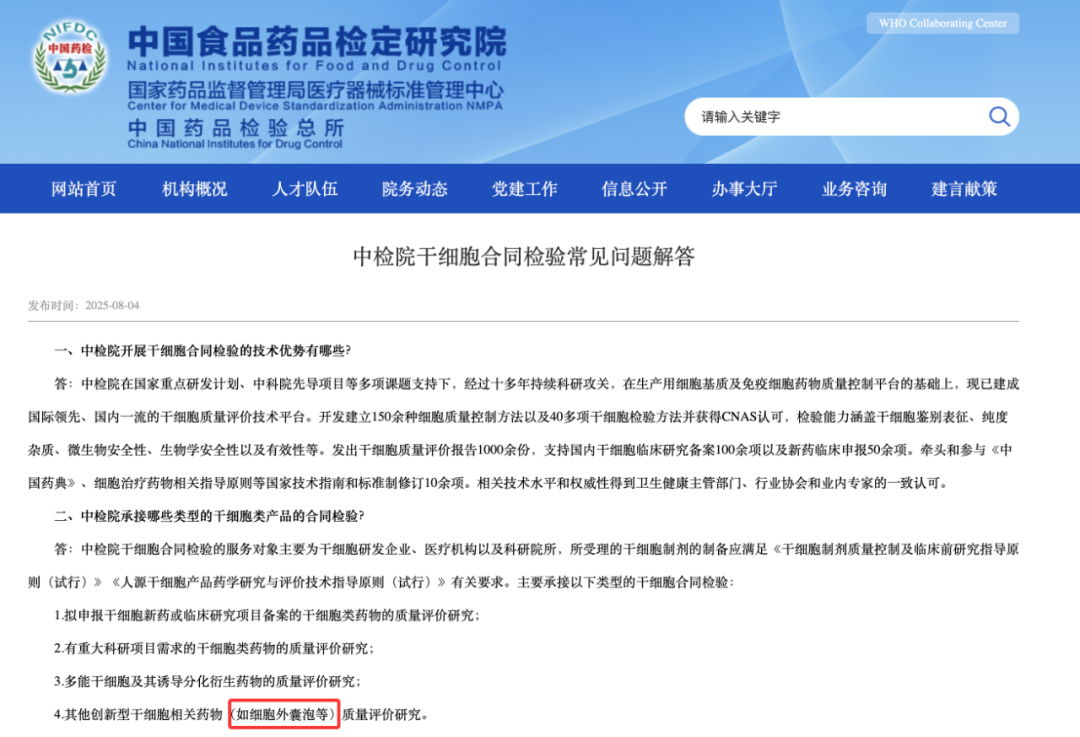
8 月 4 日,国家食品药品检定研究院(以下简称「中检院」)在其「干细胞合同检验常见问题」中首次明确:质量评价服务已扩展至「创新型干细胞相关药物(如细胞外囊泡等)」,意味着国内药监体系正式认可 EV 类产品进入法定质量评价体系。
2025 年 6 月,CDE 发布的《先进治疗药品的范围、归类和释义(征求意见稿)》,为外泌体产业扔下了一颗 "重磅炸弹":外泌体正式被纳入 "先进治疗药品"(ATMP)范畴。这可不是简单的名字变更,背后藏着三大深意:
· 身份正名,告别 "灰色地带":从此,外泌体不再是徘徊在药品、器械或化妆品边缘的 "模糊存在"。作为 ATMP 家族的一员,它的研发、生产、临床研究到上市申请,都有了一套完整且与国际接轨的监管体系。企业终于有了清晰的 "导航图",不用再摸着石头过河。
· 标准先行,竖起技术门槛:纳入 ATMP 意味着要对标国际最高标准。未来,CDE 会针对外泌体的来源、载药技术、生产工艺、稳定性等特性,制定专门的技术指导原则。这相当于为产业设了一道 "过滤网",推动高质量研发,淘汰低水平重复。
· 审评加速,研发更有底气:明确的管理类别是加速审批的基础。随着 ATMP 审评框架的成熟,外泌体新药的审评会越来越规范、高效,研发企业的信心和资本热情也将被极大点燃。
中检院最新发布的《干细胞合同检验常见问题解答》,释放出强烈的支持信号,让外泌体产业吃下 "定心丸":
· 技术储备就绪:依托 "国内一流、国际领先" 的细胞质量评价平台,中检院历经十余年攻关,已建立起涵盖外泌体的全面检验方法,为其质量控制提供国家级技术支撑。
· 评价体系接轨:外泌体的评价从一开始就植根于药品研发的规范框架内,遵循《干细胞制剂质量控制及临床前研究指导原则(试行)》等要求,确保结果专业权威,为后续审评打下坚实基础。
· 服务链条贯通:从早期研发、临床前研究到新药申报(IND),中检院的合同检验服务全程覆盖。其出具的报告作为国家权威机构的第三方评价,是企业优化工艺、与监管机构沟通的重要依据。
2024 年底,由中检院牵头,联合上海交大、同济大学、北京恩泽康泰等单位申报的国家重点专项《干细胞及其衍生物创新药的研发与监管评价技术研究》成功获批,为外泌体产业再添动力:
· 直击核心痛点:聚焦外泌体研发与监管中的关键瓶颈,如标准化、生产工艺、质量评价、效力测定等,推动产业突破技术难关。
· 打造协同链条:构建 "研发 - 生产 - 质检 - 应用 - 监管" 深度融合的创新生态,让研究成果既能对接监管需求,又能快速落地应用。
· 制定中国方案:目标是建立一套符合国际标准、兼具中国特色的外泌体监管评价体系,提升我国在该领域的国际话语权。
监管定调、技术支撑、项目加持,三股力量形成合力,正深刻改变外泌体产业的生态格局:
· 迈向高质量发展:明确的监管路径和技术门槛将加速淘汰概念炒作、缺乏核心技术的企业,资源向具备高效载药技术、GMP 车间、规模化生产工艺的头部企业集中。
· 激活创新活力:监管清晰化为资本进入铺平道路,更多资金将涌入外泌体领域,支持源头创新和临床转化,破解创新药研发的 "死亡之谷" 难题。
· 临床转化加速,患者受益可期:监管科学和评价技术的进步,将缩短外泌体药物从实验室到病床的时间,让肿瘤治疗、神经退行性疾病、组织修复等领域的患者更早受益。
· 提升国际竞争力,抢占全球制高点:中国在监管框架和科研布局上的快速跟进,让国内创新企业能与国际同行站在同一起跑线,参与全球竞争。
· 开辟健康产业新蓝海:外泌体在炎症改善、免疫调节、抗衰老等方面的潜力,与功能医学、健康管理的理念高度契合,为高端健康产业提供合规发展的新方向。
监管的破局解决了 "往哪走" 的困惑,国家队赋能筑牢了 "质量关" 的基石。中国外泌体产业的新纪元已经开启,在这场全球竞逐中,那些深耕原创技术、坚守质量底线、拥抱监管科学的企业,必将乘风破浪,让外泌体的科学奇迹惠及更多人!